На поверхности твердого тела обычно существует слой связанных молекул Поглощение молекул твердым телом называется сорбцией, обратный процесс — десорбцией, поглощающее тело — сорбентом. Эти явления имеют большое значение в вакуумной технике. Интенсивная десорбция приводит к обильному газовыделению и сильно замедляет откачку, наоборот, активная сорбция ведет к быстрому поглощению газа и используется для откачки в специальных сорбционных насосах.
На поверхности системы может быть связано много большее число молекул по сравнению с числом свободно летающих в объеме Например, в пальчиковой лампе диаметром 1 и высотой 2 см (Е= 1,57 см3, А = = 6,28 см2) при давлении Р=10“4 тор в объеме заключено А%б = PV!kT = 5,0 1012 молекул, а на поверхности «сидит» АПов=А : =4,5-15 молекул (для воз
духа диаметр молекулы о = 3,72-10'8 см) Если все эти молекулы десорбируются, то давление в лампе повышается на три порядка
Адсорбированные молекулы находятся на поверхности в состоянии динамического равновесия, когда часть молекул в результате случайных процессов отрывается и уходит и столько же частиц за это время соударяется ,с поверхностью и вновь поглощается ею. При этом количество молекул на единице поверхности остается постоянным, оно зависит от давления, температуры и от свойств материала.
Явления, приводящие к поглощению молекул, различаются по природе При физической адсорбции молекулы удерживаются на поверхности силами Ван дер Ваальса Поверхностные силы кристаллической решет-
ки не уравновешены с внешней стороны Поэтому на поверхности существуют центры адсорбции с расстояниями порядка молекулярных размеров (10~8 см), а число поглощенных молекул пропорционально площади поверхности. Адсорбированные молекулы могут располагаться мономолекулярным слоем или в несколько слоев Адсорбированное состояние устойчиво и соответ
ствует минимуму потенциальной энергии молекулы. Поэтому адсорбция сопровождается выделением энергии, которую можно характеризовать удельной теплотой адсорбции Наоборот, нагревание сообщает молекулам добавочную энергию для преодоления потенциального барьера и приводит к десорбции
Хемосорбция сопровождается образованием валентных связей молекул газа с поверхностью, некоторые реакции эндотермические, поэтому нагрев может увеличить количество хемосорбированных молекул. Абсорб цией называют объемное поглощение газов твердым телом, при этом возможны образование твердых растворов, объемная хемосорбция и другие процессы.
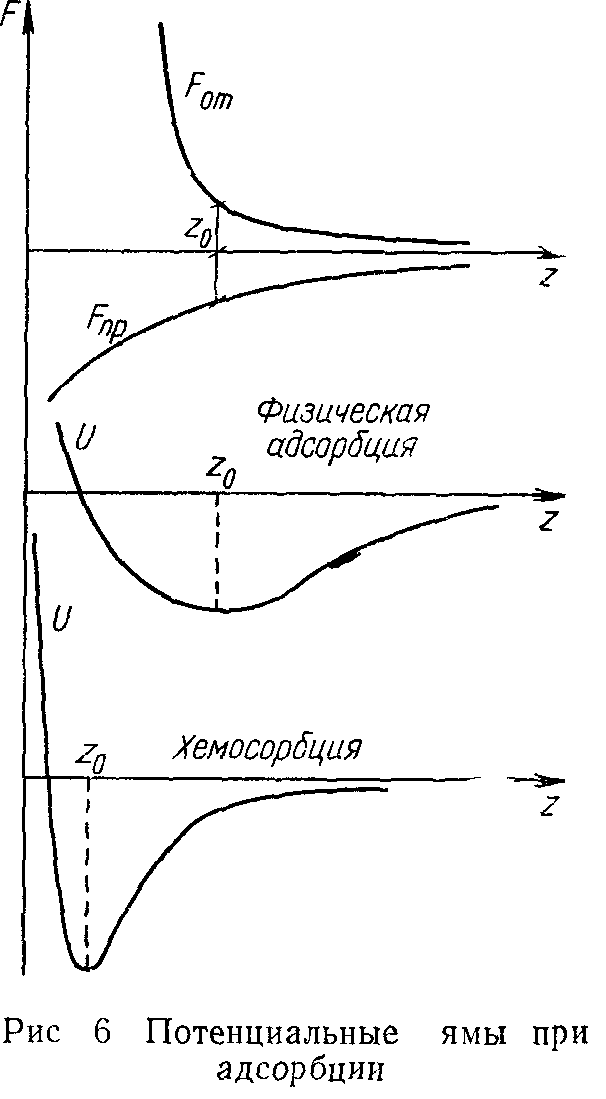
ствующие на молекулу газа, уравновешиваются, при этом имеет место минимум потенциальной энергии —— = Fnp+FOT) (рис 6) Это равновесие обла
Упрощенно можно считать, что вблизи поверхности существуют силы притяжения и отталкивания F0T, причем последние уменьшаются быстрее с удалением от поверхности На некотором расстоянии z-0 силы, дей-дает свойством устойчивости, так как при удалении молекулы (г>г0) притяжение преобладает (Fnp>F0T) и молекула приближается к z0. Наоборот, если молекула сместится от равновесия ближе к поверхности, то при z<z0 силы отталкивания (ЕОт>-Епр) вернут ее назад к z0.
Физическую адсорбцию и хемосорбцию часто трудно различить, но при последней связь обычно более прочная. Условно считают, что при глубине потенциальной ямы менее 3—4 ккал/моль имеет место физическая адсорбция, при энергии связи свыше 8 ккал/моль — хемосорбция.
Изотермами адсорбции называют кривые, показывающие зависимость равновесного количества адсорбированного газа у, на единицу поверхности или массы сорбента от давления при различных температурах. Очевидно, р должно возрастать с увеличением давления у поверхности и убывать с ростом температуры. Фрейндлих [1] предложил параболическое уравнение изотерм причем а, т и Q зависят от природы газа и сорбента. При т = 2-^5 уравнение (69) хорошо согласуется с экспериментальными данными для пористых веществ.
Из опыта известно, что часто наблюдается насыщение р с увеличением давления. Этот факт отражается гиперболическим уравнением изотерм по Ленгмюру. Пусть на единице поверхности имеется Z центров адсорбции, из них занята доля 0<1. Тогда р = —ZQ[NA моль/см2, где NA— число Авогадро. В единицу времени на единицу поверхности приходит число молекул v = nvT/4, пропорциональное давлению:
Из них сорбируется только доля а<1, причем а зависит от числа свободных центров: а = а0(1—9)- Число уходящих молекул пропорционально числу связанных частиц: р = р09- В состоянии динамического равновесия а = Р; решая относительно G = pNA/Z, получаем уравнение изотерм Ленгмюра
Здесь po=ZINа—-равновесное количество адсорбированных молей при полностью занятых активных цент-
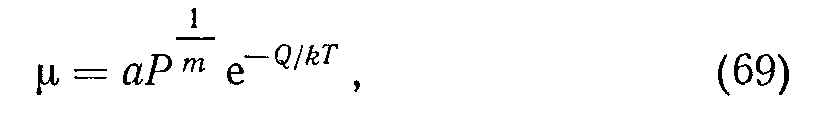
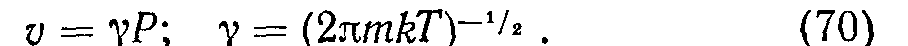
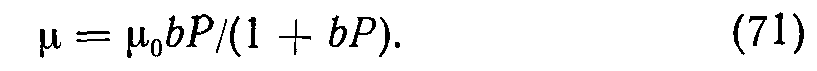
pax (на единицу площади), 6 = «оу/Ро— константа. При больших давлениях (Р^>1/Ь) получаем p = p0 = const, т. е. адсорбированное количество газа при полностью заполненном монослое не зависит от давления. При малых давлениях (RCl/b) ц = щфР, т. е. при неполном монослое приходящие молекулы занимают свободные места и адсорбция линейно растет с давлением. Поли-молекулярная (многослойная) адсорбция описывается уравнениями Брунауэра, Эммета и Теллера (теория БЭТ).
Если при адсорбции в металле молекула газа диссоциирует на два атома, то уменьшение количества газа из свободного состояния равно — VdP, где V — поглощенный объем; dP — понижение давления. Интегрируя и учитывая связь p~V, получаем ц = const ]^Р, т. е. диссоциативная растворимость газа в металле пропорциональна РЧ2. Растворимость газов в жидкостях, согласно закону Генри, пропорциональна парциальным давлениям.
Для описания адсорбции применяют также изобары (обращенные изотермы), когда на графиках для р по оси абсцисс откладывают температуру, а параметром кривых является давление. Наконец, изостеры адсорбции суть зависимости равновесного давления от температуры при p = const. Интересно, что по изостерам адсорбции можно вычислить теплоту адсорбции
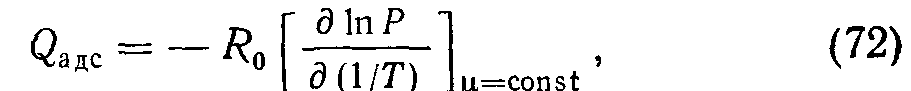
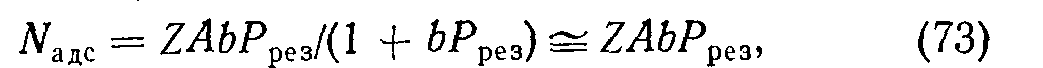
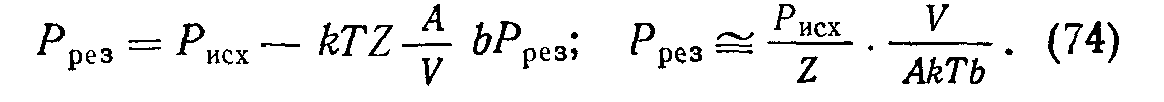
где ц — соответствующее адсорбированное количество газа; Ro—универсальная газовая постоянная.
Используем изотермы адсорбции для расчета понижения давления после введения в действие сорбента. Пусть Рисх и Ррез — исходное и результирующее давления; V — объем установки; А — площадь сорбента. Измеряя адсорбированное количество газа в числе молекул (N = PV/kT), можно написать
считая давления малыми. Очевидно, результирующее число свободных молекул Azpe3=Micx—Мщс, следовательно, для Z^> 1
При испарении вещества в вакууме над нагретой поверхностью в ограниченном объеме накапливаются молекулы пара, его давление увеличивается и усиливается обратный процесс конденсации. Равновесное давление пара называют упругостью насыщенных паров Эго давление для данного вещества возрастает с температурой: чем больше температура, тем больше скорость испарения, тем большее давление необходимо, чтобы уравновесить его конденсацией. Удельная теплота испарения А= (T/Jp) XdPIdt (кал1г), где / — механический эквивалент тепла; р — плотность пара. Экспериментально установлено, что величина L линейно убывает с температурой: L = L0—аТ. Используя р = — PmjkT, получаем
Формула Клапейрона (76) описывает зависимость упругости насыщенных паров от температуры. Обычно ее пишут в виде 1пР = Д—BIT, пренебрегая слабым членом с In Т. Например, для вольфрама /1 = 12,24; В = = 4,026-10“2, если давление выражено в торах.
Упругостью насыщенных паров обладают не только жидкости, но и твердые тела, так как испарение может происходить из твердой фазы. Упругость — это максимальное давление вещества при данной температуре. Пар в состоянии насыщения не подчиняется закону Бойля-—Мариотта, сжатие его приводит к усилению конденсации при сохранении исходного давления, равного упругости паров. Высокое значение упругости может ограничить возможность получения вакуума. Например, наличие воды в системе не позволит понизить давление ниже 17,5 тор до полного испарения воды (табл. 7).
Таблица 7
после интегрирования имеем
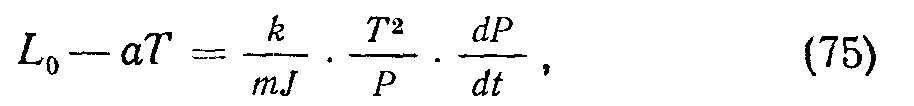
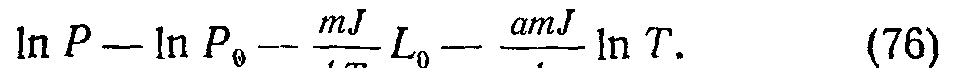
Упругость паров ртути при 20°С составляет 2Х10-3 Т0Р> поэтому без ловушек нельзя получить более низкое давление с помощью ртутных диффузионных насосов. Большую роль играет упругость паров масел, уплотнителей, конструкционных материалов и т. д.
Скорость испарения веществ можно оценить из условия равновесия тЦРп=Тконл, причем v = — PnvT/kT, где
Рп—равновесное давление пара. Следовательно,
Таблица 8
|
Газ |
Азот |
Водород |
Гелий | |||
|
t, сс |
—206,2 |
—195,8 |
—256,2 |
—252,7 |
—269,9 |
—268,9 |
|
р, тор |
177,6 |
760 |
232,5 |
760 |
197 |
760 |
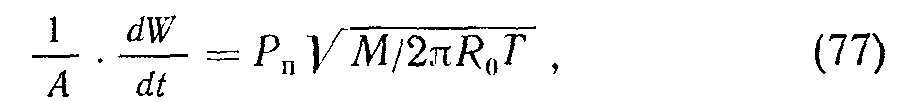
где М— молекулярный вес; IF — масса вещества, испаряющегося с поверхности А. Для меди при 942°С упругость паров равна 10~3 тор, скорость испарения 1,33 10'7 г/ {сек-см2)-, при 1084°С (точка плавления) упругость паров меди составляет 2,6-10-4 тор.
Для уменьшения упругости паров в вакуумных установках применяют поверхности (ловушки), охлаждаемые снаружи жидкими газами. При этом внутри системы не конденсируются молекулы того газа, который используется для охлаждения, поскольку при температуре ожижения упругость паров любого газа равна 760 тор (табл. 8).
Если металлическая поверхность установки покрыта соединениями с кислородом, воздухом или азотом, то при нагревании эти соединения могут диссоциировать с накоплением в объеме соответствующего газа. Равновесное давление кислорода, при котором скорость диссоциации равна скорости обратного процесса окисления поверхности установки освободившимся кислородом, называется упругостью диссоциации окисла. Например, для реакции разложения окиси меди упругость кислорода равна 4,36-10—8 тор при 427° С и 1,97- 10 3 тор
при 627° С. Упругость диссоциации окислов, гидридов и нитридов возрастает с температурой по экспоненциальному закону, подобному формуле Клапейрона [см. уравнение (76)], и при высоких температурах также может ограничить возможность получения низких давлений.
Количество и состав газов, поглощаемых металлами, зависят от способа получения металла. Например, металлы сильно насыщаются газами при плавке; чтобы избежать этого, применяют плавку в вакууме. Условно по газопоглощающей способности можно расположить металлы в ряд: железо, никель, медь, молибден, вольфрам. Ориентировочно вольфрам и молибден содержат 0,5—1 н. см3 газов на 0,1 кг металла *, обез-гаженный никель — до 10 н. сл3/0,1 кг, необезгаженное железо — несколько сот н. см3/0,\ кг. Никель содержит СО2; железо — СО2 и N2; медь — Н2, СО2, N2. Промышленность выпускает бескислородную медь.
Водород образует гидриды с щелочными (NaH) и щелочноземельными (СаН2) металлами. Металлы С а, Ag, Mo, W, Fe, Ni образуют с газами твердые растворы с содержанием, экспоненциально зависящим от температуры (p~ Pe~Q/hT). В металлах Pd, Zr, Та, Ti растворимость газов очень велика. Например, 1 см3 палладия может поглотить до 103 см3 водорода. Медь в результате поглощения водорода при нагреве в его атмосфере рыхлится и теряет герметичность (водородная болезнь меди).
Кислород образует окислы, особенно с щелочными и щелочноземельными металлами, в меньшей степени — с медью и железом. Водяной пар поглощается металлами в результате физической адсорбции. Азот поглощается только теми металлами, которые образуют нитриды (Fe, Та, Mo, W, Ni), причем зависимость растворимости азота в железе от температуры имеет немонотонный характер со сложными аномалиями.

