Давление газа принято определять как суммарный импульс молекулярных ударов, передаваемый в единицу времени единице поверхности, ограничивающей вакуумный объем. Давление используется для описания разрежения по традиции, хотя ограничивающей стенки можег и не быть (например, космос); в то же время для большинства явлений в вакууме важно не давление как силовой эффект, а концентрация молекул в единице объема.
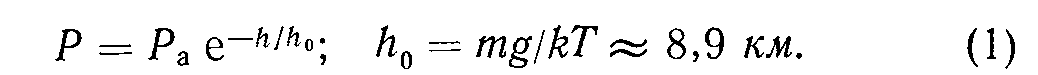
Если тепловая скорость молекул V, то при упругом ударе по нормали передаваемый стенке импульс равен 2nw, а давление P = 2mvv, где v — частота ударов о единицу поверхности Пусть п — число молекул в единице объема. Предполагая движение п/6 молекул вдол! положительного направления каждой из трех коорди натных осей, легко показать, что v = nvjQ и соответст венно
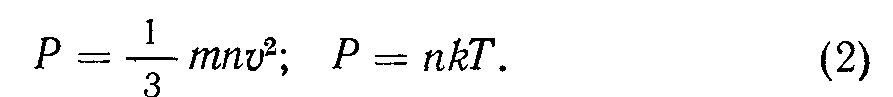
Учет неперпендикулярного движения молекул под углом й к стенке приводит к интегрированию числа молекул пгШ/4л по элементам телесного угла ЙЙ = = sin ййййср:
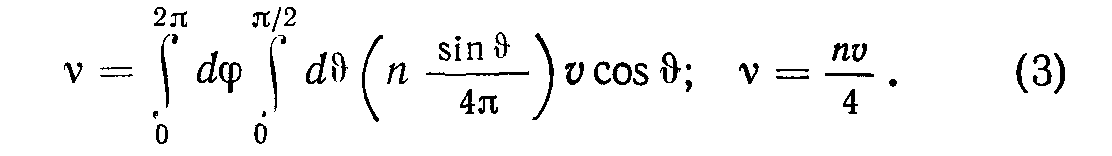
Это выражение является более правильным, чем v= = nv/6, получаемое из элементарных соображений. Подставляя значения постоянных, получаем
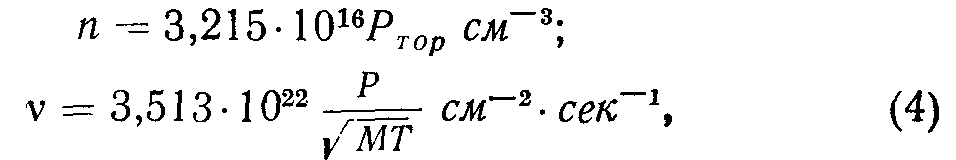
где М — молекулярный вес газа. Согласно закону Аво-гадро, равные объемы любых газов при одинаковых температуре и давлении содержат одинаковое число молекул. При давлении 760 тор и температуре 20° С в 1 смя любого газа заключено 2,687 ПО19 молекул (число Лошмидта). Грамм-молекула, или моль, — это количество газа, вес которого в граммах равен молекулярному весу Число молекул в 1 моле любого газа равно А'д = 6,023 • 1023 моль~1 (число Авогадро).
Умножив уравнение (2) на объем газа V, получим
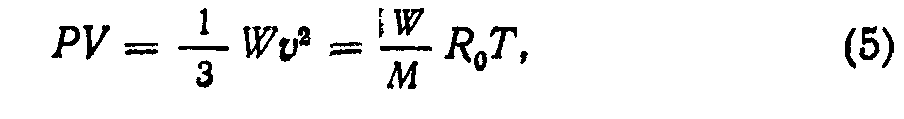
где W = mnV— масса газа; /?о = 62,364 тор-л/(градХ Хмоль)—универсальная газовая постоянная Уравнение газового состояния (5) объединяет законы Бойля — Мариотта (PV=const для данной массы) и Гей-Люссака (VdV2=TJT2 при P = const и Р\1Р2 = Т\/Т2 при У = = const). Отсюда следует, что величина PV—мера количества газа. Она более удобна для использования вместо массы или количества молекул, так как давле ние и объем газа легко измерить Для воздуха (М = = 28,7) при 7=300° К имеем [201
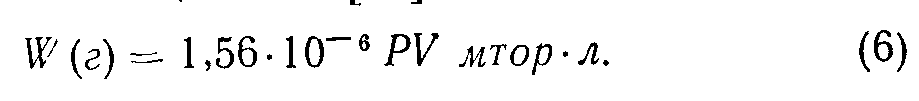
По закону Дальтона, относящемуся к смеси разных газов, общее давление смеси равно сумме парциальных давлений отдельных компонент:
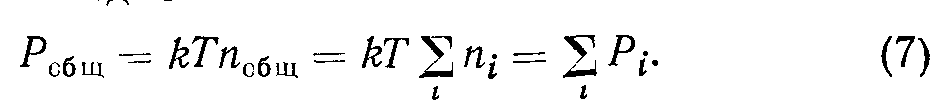
Эти законы действительны для идеальных газов С учетом размеров молекул и их взаимодействия вместо уравнения (5) применяют уравнение Бан дер Ваальса для 1 моля:
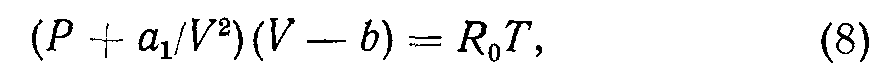
где Hj — величина, зависящая от силы взаимодействия , ... 4 /а\3
молекул; b = 4NA— л'— —величина, пропорциональ-3 \ 2 J
ная объему молекул; о — диаметр молекулы Распределение молекул газа по скоростям описывается функцией Максвелла (dn = nf (v)dv).
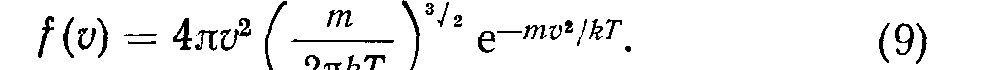
Из условия df/dv = O получаем наиболее вероятную скорость; усредняя и и v2 по f (у), имеем среднюю и среднеквадратическую скорости:
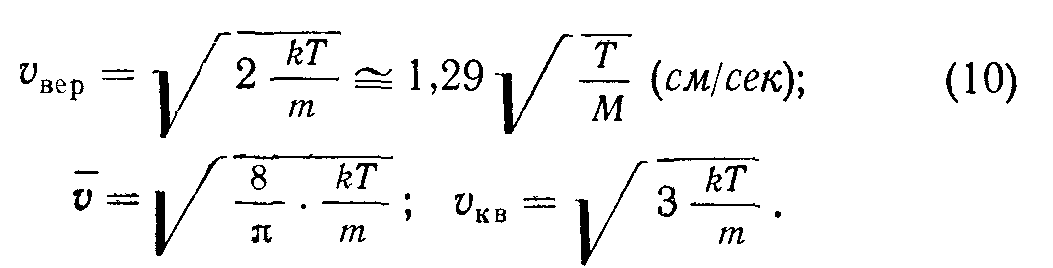
При комнатной температуре (20° С) средняя скорость молекул воздуха равна 465 м/сек.
Будем считать, что соударения молекул происходят тогда, когда расстояние между их центрами уменьшается до о. При движении молекула в единицу времени проходит путь со скоростью v и «задевает» молекулы, заключенные в объеме цилиндра (nncPv). Отсюда средняя длина свободного пути равна
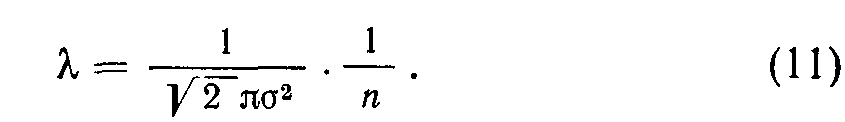
Здесь 2 появился из-за учета распределения Максвелла. Средняя длина свободного пути молекул обратно пропорциональна давлению или концентрации молекул и является важной характеристикой вакуума. Для воздуха при температуре 20°С имеем Цсж) = = 5/Р (лгтор), например при 10~6 тор Х = 50 м Если учитывать зависимость от температуры, то следует умножить уравнение (11) на величину (1+«2/7')-1, где а2— постоянная Сазерленда: «2=103 для N2 и а2 — = 136 для О2.
Величина X имеет статистический смысл; например, если рассматривать рассеяние молекулярного пучка, движущегося в направлении г, то его интенсивность убывает по закону иоехр(—z/X). После прохождения пути z = X число нерассеянных молекул составляет 0,367 п0, т. е. после прохождения средней длины свободного пути соударение претерпели 63% молекул.
Для смеси двух газов можно ввести Л12 — для столкновений молекул газа 1 с молекулами газа 2:
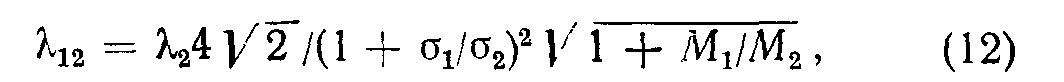
где Хг — относится к собственным соударениям газа 2. Если /’[С/’г, то для газа 1 важна величина Мг, а не Zi. Например, относительное содержание гелия в воздухе составляет 1/200 000, поэтому Хг-В = 2,1ХВ.
Молекулы при соударении с поверхностью задерживаются на ней короткое время. Поэтому в отличие от отражения света угол отражения молекулы не зависит от угла ее падения на поверхность. Отраженные молекулы распределены по косинусоидальному закону (рис. 1):
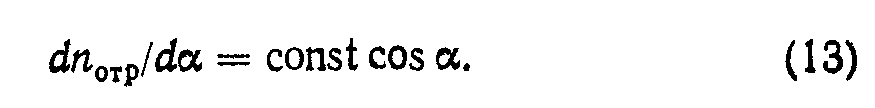
Наибольшее число моЛекул Отражаемся по норМаЛИ к поверхности; с приближением направления разлета к касательной число молекул уменьшается до нуля. Этот закон имеет пространственно-сферический характер.
кууме зависит от характера соударений молекул. Если 1, то преобладают взаимные соударения молекул, это состояние называют низким вакуумом. Наоборот, при л/'Д 2Э> 1 основное значение имеют соударения молекул с ограничивающими поверхностями; молекулы редко встречаются друг с другом при высоком вакууме. Промежуточное состояние
Степени вакуума классифицируют по параметру l/d, где d — характерный геометрический размер системы, так как большинство физических явлений в ваf.»d соответствует среднему вакууму.
В этом отношении атмосферное давление 760 тор (для воздуха Х = 6,6Х10~6 см) может соответствовать высокому вакууму в порах твердых тел диаметром d~5-10-8 см.
Для определения сверхвысокого вакуума часто используют другой принцип: сверхвысокий вакуум — это такое давление, когда обращенная в вакуум поверхность может сравнительно долгое время оставаться свободной от адсорбированных молекул. На единице площади в полном монослое умещается число молекул, /г(72 \
равное 1 J. Если в начальный момент поверхность идеально очищена, то время укомплектования монослоя молекул равно t (сек) = 1—— = 2,44- 108/Р (тор) для воздуха при 300° К, что составляет 4 мин для Р = = 10~8 тор.
В тех случаях, когда это время достаточно для экспериментов с чистой поверхностью, давление 10“чтс'р можно считать условной границей сверхвысокого вакуума.

